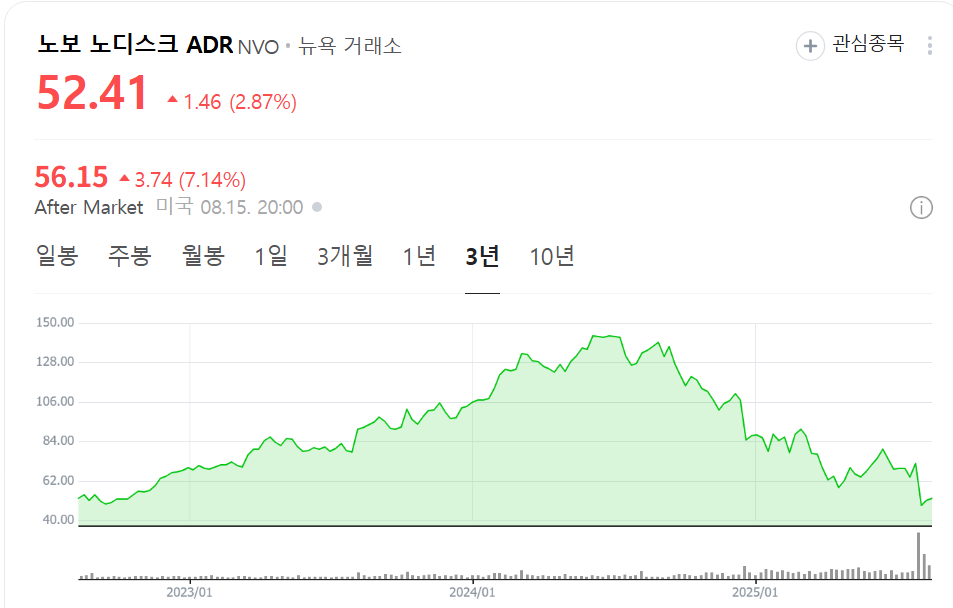
중간중간에 트레이딩 하면서 수익도, 손절도 모두 겪어본 기업...이렇게 될것이라면 왜 이렇게 때려 버린건지...그런데 또 이렇게 될 것은 아무도 알 수가 없는 것이 주식
노보 노디스크는 오늘 미국 식품의약국(FDA)으로부터 Wegovy®(세마글루타이드 2.4mg) 의 추가 적응증 승인을 받았다고 발표했습니다. 이번 승인은 비간경변(noncirrhotic) 대사기능이상 관련 지방간염(MASH) 을 앓고 있는, 중등도에서 진행성 간 섬유화(섬유화 단계 F2~F3) 를 가진 성인 환자를 대상으로 하며, 저칼로리 식단과 신체 활동 증가를 병행하는 조건입니다.
이번 신속 승인(accelerated approval)은 ESSENCE 임상시험 1부 결과를 기반으로 했으며, Wegovy®는 위약 대비 ▲간 섬유화 개선(간염 악화 없이) ▲간염 소실(간 섬유화 악화 없이)에서 통계적으로 유의하고 우수한 개선 효과를 보였습니다.
ESSENCE 임상 데이터에 따르면, 72주차에서 아래와 같이 달성했습니다.
간 섬유화 개선(간염 악화 없이) : Wegovy® 투여군 36.8%, 위약군 22.4%
간염 소실(간 섬유화 악화 없이) : Wegovy® 투여군 62.9%, 위약군 34.3%
노보 노디스크의 마틴 홀스트 랑게 부사장 겸 최고과학책임자(CSO)는 다음과 같이 밝혔습니다.
“Wegovy®는 이제 MASH 치료에 승인된 최초이자 유일한 GLP-1 치료제가 되었습니다. 이미 입증된 체중 감량, 심혈관 질환 예방 효과, 그리고 세마글루타이드에 대한 광범위한 근거에 더해 새로운 치료 옵션을 제공합니다.MASH는 전 세계적으로 과체중 또는 비만 인구 3명 중 1명에게 영향을 미치는 심각한 건강 부담입니다. 미국 내에서도 약 2,200만 명이 MASH를 앓고 있는 것으로 추정됩니다. 이번 승인으로 MASH 환자들에게 질병 활동을 멈추는 것뿐 아니라 간 손상을 되돌리는 데 도움을 주는 새로운 치료제를 제공하게 되었습니다.”
오늘부로 Wegovy®는 미국에서 MASH 치료제로 사용 가능합니다.
아래는 얼마전에 내용
Wegovy is first GLP-1 treatment approved for MASH
FDA decision based on part one of an ongoing study
Novo Nordisk seeks approval in Europe and Japan
Aug 15 (Reuters) - Novo Nordisk (NOVOb.CO), opens new tab said on Friday the U.S. Food and Drug Administration has granted accelerated approval for its weight-loss drug Wegovy to treat a serious liver condition called metabolic dysfunction-associated steatohepatitis, strengthening its presence in the metabolic disease market.
The approval makes Wegovy the first GLP-1 class therapy cleared for MASH, a progressive liver condition that affects around 5% of adults in the United States, according to the American Liver Foundation.
"There really (have) not been good treatments in this space. We're only the second FDA-approved treatment for MASH, and we really need better medications that have better overall benefit-risk profiles, that really can also prevent the progression of the disease," Jason Brett, principal U.S. medical head at Novo Nordisk, said in an interview with Reuters.
So far, the only available FDA-approved treatment for MASH is the Madrigal Pharmaceuticals drug (MDGL.O)
, opens new tab Rezdiffra, which was approved in 2024.
The FDA's decision was based on part one of an ongoing two-part study that showed Wegovy helped improve the organ's condition in more patients with MASH and liver scarring, compared to a placebo.
Novo Nordisk said the drug is now available in the United States for adults with MASH and moderate to advanced liver scarring, and is to be used alongside proper diet and exercise.
"MASH patients need access to treatments - and that really can help them, especially early - to prevent it from progressing," Brett said. "We're doing as much as we can to work and partner with the payer community around enhancing access and reimbursement."
Brett did not provide any pricing details.
Based on results from part one of the trial, Novo has applied this year for approval in Europe and Japan. Further results from part two of the trial are expected in 2029.
Rival Eli Lilly's (LLY.N), opens new tab tirzepatide - the active ingredient in its popular diabetes drug Mounjaro and weight-loss treatment Zepbound - previously helped up to 74% of patients achieve absence of MASH with no worsening of scarring in a mid-stage trial.
Accelerated approvals allow the FDA to move therapies that target serious and life-threatening conditions to the market more quickly. However, such approvals have been criticized because some drugs have later been proven to be ineffective.

Novo Nordisk said on Friday the U.S. Food and Drug Administration has granted accelerated approval for its weight-loss drug Wegovy to treat a serious liver condition called metabolic dysfunction-associated steatohepatitis, strengthening its presence in the metabolic disease market.
www.reuters.com
Disclaimer
- 당사의 모든 콘텐츠는 저작권법의 보호를 받은바, 무단 전재, 복사, 배포 등을 금합니다.
- 콘텐츠에 수록된 내용은 개인적인 견해로서, 당사 및 크리에이터는 그 정확성이나 완전성을 보장할 수 없습니다. 따라서 어떠한 경우에도 본 콘텐츠는 고객의 투자 결과에 대한 법적 책임소재에 대한 증빙 자료로 사용될 수 없습니다.
- 모든 콘텐츠는 외부의 부당한 압력이나 간섭없이 크리에이터의 의견이 반영되었음을 밝힙니다.
