
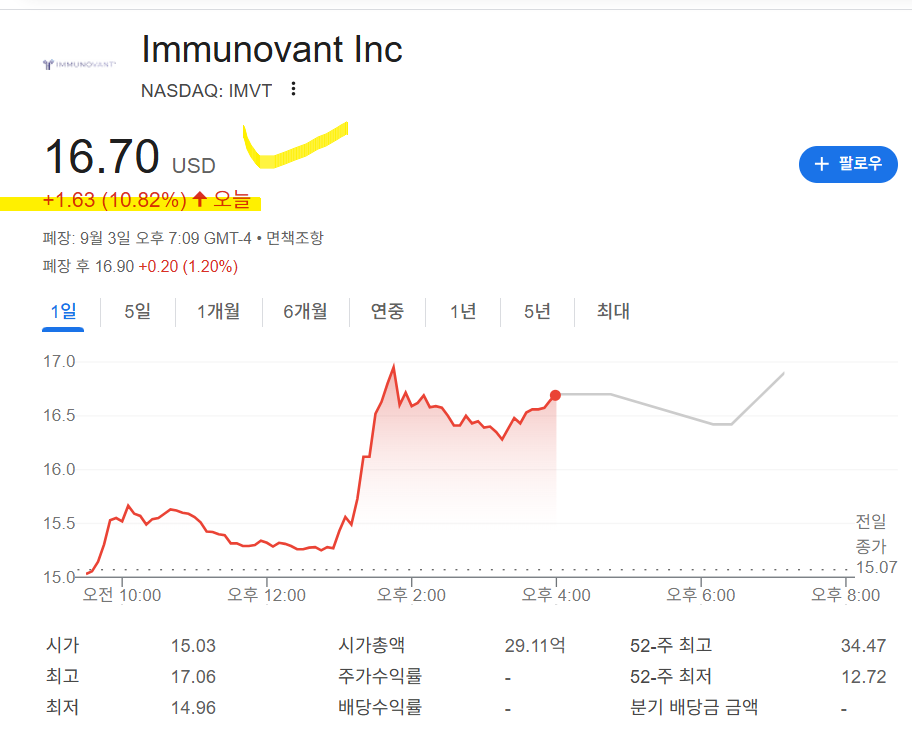
한올바이오파마에게 기술 이전을 받아서
연구하고 있는 이뮤노반트(모회사인 로이바트에게 이전함)의 주가가
다시 반등했다.
최근 연구결과가 잘 나와서 기대감으로 오른 것으로 보이는데
어떻게 나왔나 확인해보자.
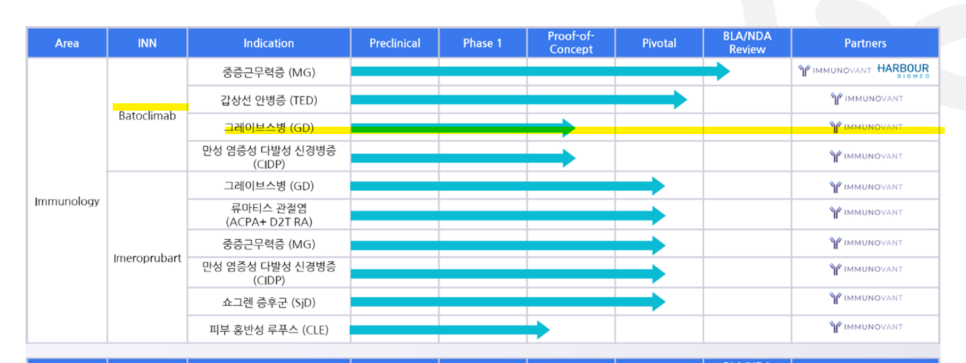
이뮤노반트가 타겟으로 하고 있는
그레이브스병은?
그레이브스병은 자가항체로 인해 갑상선호르몬이 과도하게 분비되는 자가면역질환으로, 주로 20~50대 여성에게 많이 발생함.
증상으로는 체중 감소, 심계항진, 피로, 안구 돌출 등이 있으며, 안병증이 동반될 수 있다.
진단은 혈액검사와 항체 검사로 이루어지며, 필요 시 영상검사를 병행함.
치료는 항갑상선제, 방사성요오드 치료, 수술 등이 있으며, 환자 상태에 따라 결정된다.
*보통 항갑상선제를 이용한 약물치료로 시작하며, 재발 시 방사성 요오드 치료나 수술을 고려함.
*이뮤노반트는 이 병에 대해서 연구하고 있음
본문 핵심만 요약하면

이뮤노반트는 한올바이오파마로부터 기술 이전받은 바토클리맙으로 진행한 그레이브스병 임상 2상에서 치료 종료 후 6개월간 약 80%의 환자가 정상 호르몬 수치를 유지하는 성과를 발표했다.
이 중 절반은 항갑상선제 없이 관해를 유지해 치료 혁신 가능성을 보여주었고, 후속 신약 IMVT-1402의 글로벌 임상도 진행 중으로 2027년 주요 결과 발표가 기대된다.
이뮤노반트 급등 이유는

그만큼 잘 나왔다라는 것이 핵심이다.
한올바이오파마의 자가면역질환 치료제 ‘HL161’이 그레이브스병 임상 2상에서 치료 종료 후 6개월간 환자 80%에서 갑상선 호르몬 정상 유지 효과를 보였음.
이 중 절반은 항갑상선제 없이도 호르몬 수치를 안정적으로 유지해, 기존 치료에 반응하지 않던 환자에게 근본 치료 가능성을 제시함.

치료 혁신 가능성: Batoclimab은 중증 조절되지 않는 그레이브스병(Graves’ disease) 환자에게 질병을 수정할 수 있는(first-ever disease-modifying) 잠재력을 보여줌.
6개월 치료 중단 후 결과:
치료 후 6개월간 약물 없이 관찰된 21명 중 약 80% (17명)이 정상 갑상선 기능(T3/T4 ≤ 정상 상한선) 유지.
이들 중 약 50% (8명)은 항갑상선제(ATD) 없이 완전 관해(remission) 상태 유지.
추가로 약 30% (5명)은 ATD 소량(2.5mg/일) 복용 상태.
치료 과정 요약:
Batoclimab 투여:
680mg/주 (0–12주),
340mg/주 (12–24주) → 이후 치료 중단하고 24주 추적 관찰.
안전성: 기존 연구와 일관된 안전성과 내약성 확인됨.
후속 개발:
차세대 약물 IMVT-1402에 대해 용량감소 없이 600mg/주 52주 투여하는 글로벌 임상 3상(잠재적 시판 승인 임상) 2건이 진행 중.
2027년 주요 결과 발표 예정.
질병 수정 가능성을 보인 batoclimab 데이터는 그레이브스병 시장에서 혁신 치료제로서의 상업적 잠재력을 강화하고
IMVT-1402의 글로벌 3상 진행 중이며, 2027년 주요 결과 발표는 향후 주가에 큰 촉매제가 될 수 있음.
높은 관해율과 약물 중단 후 지속 효과는 경쟁 약물 대비 차별성을 부각시키며, FDA 승인 기대감을 높음.
*그대로 번역하자면
이뮤노반트, 치료 중단 후 6개월 지속된 반응 및 무치료 관해 데이터 공개 - 조절되지 않는 그레이브스병 치료 패러다임 변화 가능성 제시
2025년 9월 3일 오후 12시 57분(미 동부시간 기준)
조절되지 않는 그레이브스병 환자를 위한 최초의 잠재적 질병 조절 치료법
24주간 바토클리맙(batoclimab) 치료 후 6개월간 치료 없이 경과 관찰한 환자 21명 중 약 80%(17명)가 정상 갑상선 기능(T3 및 T4가 정상 상한 이하)을 유지함.
이 17명 중 약 50%(8명)는 치료 중단 6개월 후 항갑상선제(ATD) 없이도 관해 상태에 도달.
그레이브스병에 대한 IMVT-1402의 잠재적 등록 임상시험 2건이 현재 등록 중이며, 2027년 주요 결과 발표 예정.
로이반트(Roivant)는 이번 업데이트와 관련된 투자자 설명회를 2025년 9월 3일 오후 4시 30분(미 동부시간) 개최 예정.
뉴욕, 2025년 9월 3일 (GLOBE NEWSWIRE) -면역질환 치료를 통해 사람들의 정상적인 삶을 가능하게 하는 것을 목표로 하는 임상단계 면역학 회사 이뮤노반트(Immunovant, Inc., 나스닥: IMVT)는 오늘, 조절되지 않는 그레이브스병(GD) 환자에서 바토클리맙 24주 치료 후 6개월간 치료 없이 지켜본 데이터를 발표했다. 해당 데이터는 2025년 9월 11일 열리는 미국 갑상선학회(ATA) 연례 학회에서 발표될 예정이다.
"이번 새롭고 고무적인 결과는 FcRn 차단이 그레이브스병 치료에 효과적인 메커니즘일 수 있음을 지지하며, 6개월 관해 데이터는 질병 조절 가능성을 시사합니다" - 조지 카할리 박사, 주연구자
"이번 데이터는 기존 치료에 반응하지 않았던 환자들에서 바토클리맙 치료 종료 후 6개월간 지속된 반응과 항갑상선제 없이 관해를 보인 사실을 보여줍니다. FDA 승인을 받는다면 환자와 임상의 모두에게 획기적인 전환점이 될 수 있습니다"-에릭 벤커 박사, 이뮤노반트 CEO그레이브스병 개념 증명 연구 (Proof-of-Concept Study)
바토클리맙은 FcRn을 표적으로 하는 이뮤노반트의 1세대 완전 인간 단일클론항체임.
연구는 24주간의 치료 기간(680mg/주, 12주 → 340mg/주, 12주 점진적 감량) 후 24주간의 치료 중단 경과 관찰로 구성.
활성형 그레이브스병 환자를 대상으로, TRAb(갑상선자극호르몬 수용체 항체) 상승 및 항갑상선제 치료에도 갑상선 기능 항진 상태인 환자들이 대상.
주요 평가지표는 치료 종료 시점(24주)에서 항갑상선제 용량 증가 없이 자유 T3, T4 수치가 정상 범위 이하 또는 그 이하인지 여부.
6개월 무치료 경과 관찰 결과
총 25명 등록, 21명이 치료 종료 후 6개월 관찰에 참여.
치료 종료 후 6개월 시점(48주차)에 21명 중 약 80%(17명)가 T3/T4 수치가 정상 상한 이하 유지 → 치료 효과의 지속성 입증.
이 17명 중:
약 50%(8명)는 항갑상선제 복용 없이 관해 상태.
추가로 약 30%(5명)는 항갑상선제 2.5mg/일의 저용량 유지 → 점진적 감량 설계에도 긍정적 반응.
안전성 및 내약성은 기존 바토클리맙 연구 결과와 일치.
IMVT-1402 등록 임상시험 설계
IMVT-1402는 바토클리맙 후속 신약 후보로, 600mg 용량을 52주간 감량 없이 투여하는 임상 진행 중.
글로벌 임상시험 2건이 현재 등록 중이며, 2027년 주요 결과 발표 예정.
이번 임상 결과는 바토클리맙이 기존 치료에 반응하지 않던
그레이브스병 환자에게 획기적인 치료 옵션이 될 수 있음을 보여줌
치료 종료 후에도 높은 비율의 환자에서 호르몬 수치가 정상 유지되며,
일부는 항갑상선제 없이도 관해를 유지한 점이 주목받고 있다.
후속 후보물질인 IMVT-1402의 글로벌 임상도 순항 중이며,
2027년 발표될 주요 결과가 시장의 큰 관심을 받을 것으로 기대되며
이뮤노반트의 기술력과 임상 데이터는 향후 주가와 치료 패러다임 모두에 중요한 전환점을 제공할 수 있음.
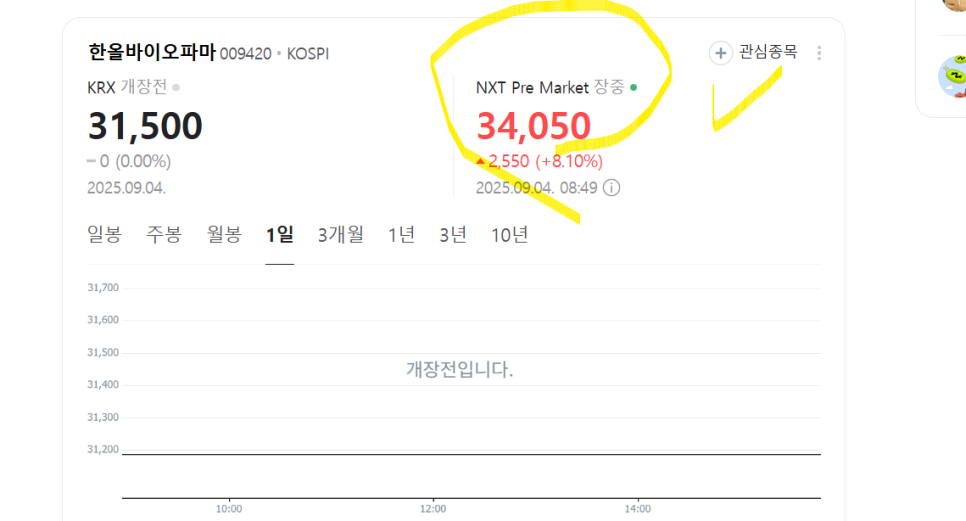
한올의 주가 전망도 밝아보인다.
Disclaimer
- 당사의 모든 콘텐츠는 저작권법의 보호를 받은바, 무단 전재, 복사, 배포 등을 금합니다.
- 콘텐츠에 수록된 내용은 개인적인 견해로서, 당사 및 크리에이터는 그 정확성이나 완전성을 보장할 수 없습니다. 따라서 어떠한 경우에도 본 콘텐츠는 고객의 투자 결과에 대한 법적 책임소재에 대한 증빙 자료로 사용될 수 없습니다.
- 모든 콘텐츠는 외부의 부당한 압력이나 간섭없이 크리에이터의 의견이 반영되었음을 밝힙니다.

